DNAオリゴマーの化学合成について
DNAは、デオキシリボヌクレオチドのデオキシリボースの3'-水酸基と5'-水酸基とが、分子間リン酸ジエステル結合でつながった構造をしています。そこで、デオキシリボヌクレオチドを順次結合させて目的の配列を持ったDNAオリゴマーを合成するには、水酸基とリン酸基の保護と効率良くリン酸ジエステル結合を形成させることが大切です。これらの問題は、固相法とホスホアミダイト法を用いて3'末端から5'末端方向に合成することで解決されています。すなはち、3'末端のヌクレオチドを3'-水酸基を介して担体に結合させたものをカラムに詰め、5'-水酸基の保護基を外した後、これに、5'水酸基が保護され3'水酸基が三価のリン酸アミダイト誘導体になった塩基を反応させてリン酸ジエステル結合させる方法です。
ホスホアミダイト法についてもう少し詳しく
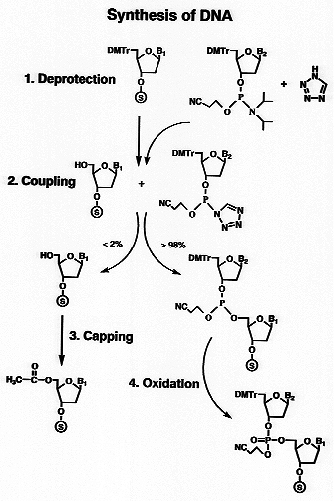
ホスホアミダイド法によるDNAオリゴマーの合成は、以下に示します4つのステップを順次繰り返すことで目的とするヌクレオチド配列を持ったDNAオリゴマーを合成します。(図を参照)
固相法による自動合成装置によるDNAオリゴマーの合成は3'-末端から5'-末端の方向に1塩基づつつないで行く方法で合成を行います。従って、合成しようとするDNAオリゴマーの塩基配列を入力した後、不活性のサポートに合成しようとするDNAオリゴマーの3'-末端の塩基が結合したカラムを装置にセットすることから合成を始めます。
ステップ1:5'-トリチル基の除去(Detritylation)
リボースの5' 位の保護基であるジメトキシトリチル基をはずします。この保護基の吸光度を比色計でモニターすることによって合成収率が検出出来ます。
ステップ2:塩基の結合(Coupling)
リボースの3' の水酸基がリン酸シアノエチルアミダイド誘導体である2番目のヌクレオチドを、脱トリチル化された1番目のヌクレオチドの5' 位水酸基に塩基触媒を用いて結合させます。
ステップ3:キャッピング(Capping)
未反応の5' 水酸基をアセチル化することによって3番目のヌクレオチドを結合させる次のサイクルに関与しないようにします。通常2%位が未反応物となります。
ステップ4: 酸化(Oxidation)
2つのヌクレオチド間の結合を、ヨードを用いて酸化して3価のリンから5価のリン酸エステルに変換します。
ヌクレオチドの結合が終われば
オリゴヌクレオチドの切り出し、デプロテクションおよび精製
- 装置のカラムホルダーからサポートカセットを取り出し1.5mlのプラスティックSarstedチューブに入れて遠心し、トラップされているアセトニトリルを除去します。(この状態で合成依頼者にお渡しします)
- カセットを、新しい1.5mlのプラスティックのSarstedチューブに移し、0.5mlの25%アンモニア水を加え遠心します。さらに、0.5mlの25%アンモニア水を加え遠心し、アンモニア水の総量を1.0mlとします。
- カセットの入ったSarstedチューブを、1mlのアンモニア水を含んだスクリューキャップ付きの小さなガラス瓶に入れます。直ちにガラス瓶のスクリューキャップをきつく締め、テープでシールします。
- シールをしたガラス瓶を、70℃で1時間 a)ウォターバス または b)オーブン中にて加熱します。。
- シールしたガラス瓶を室温になるまで冷却し、キャップを開け、ガラス瓶からSarstedチューブを取り出します。(ピンセットを使ってください。)
- 注意深くSarstedチューブからカセットを取り出し(ピンセットを使ってください。)、新しい1.5mlのエッペンドルフチューブに移し遠心してカセット内部のアンモニアを回収します。(この溶液に、合成したオリゴマーの大部分が含まれています。
- カセットを別のチューブに移して、カセットの窪んだ部分にアンモニア水を0.5ml加えて遠心しアンモニア水を回収してください。さらに、同じ操作をもう一度行いアンモニア水を回収してください。
- 蒸留水(オリゴマーを溶解する溶媒)で平衡化したNAP-10カラムに回収したアンモニア水をチャージします。この時、溶出液は回収しません。
- 1.5mlの蒸留水を加えて、オリゴマーを溶出します。1.5mlの蒸留水を加えてから溶出してくる分画は全部回収してください。これで低分子の不純物が除かれたDNAオリゴマー水溶液が得られます。通常このままでPCRのプライマーとして使用することができます。
なお、精製したオリゴヌクレオチドは乾燥状態で-20℃以下で保存するのがよい。

![[GuideBook Contents]](../../../button/gbcont.gif)
![[ SUMS Home Page ]](../../../button/sumshp.gif)
![[ CRL Home Page ]](../../../button/crlhp.gif)