光学顕微鏡用試料作製−パラフィン切片作製および染色法について−
新井 良八(解剖学第一)
奥野 弘志(実験実習機器センター)
山元 武文(実験実習機器センター)
−免疫組織化学−
免疫組織化学は抗原−抗体反応という免疫反応を基盤としています。組織・細胞中の抗原性のある物質に対して特異抗体を作用させます。特異抗体に、あらかじめ光学顕微鏡で発色して見える物質を標識抗体としてつけておき、これと反応する組織・細胞中の抗原の場所が観察できます。
免疫組織化学では、組織・細胞内の機能の明確な局在を明らかにし、機能と形態、構造との関連を解明することです。
現在では酵素標識抗体を用いる酵素抗体法が行われています。また、電子顕微鏡で検鏡する場合は、特異抗体に電子密度の高い物質(鉄、金、ウラニウム)を標識し観察します。
今回の実習では、streptavidin-biotin peroxidase complex (SABC)法の具体的な手技を以下に示します。
SABCの原理
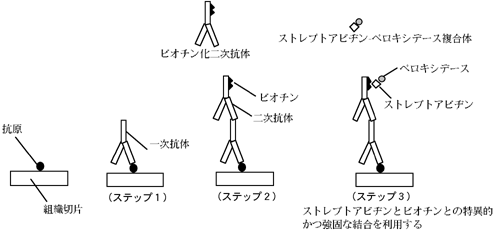
(ステップ4)は切片をDAB溶液に入れ、ペロキシデース活性によってDAB分子を酸化的重合し巨大分子にして可視化させる。
染色法
| 1 | PBS | 5ハャ x 2 |
| 2 | 0.3% Triton X-100 in PBS | 20分 |
| 3 | PBS | 5ハャ x 2 |
| 4 | 5% 正常ヤギ血清 | 10分 |
| 5 | PBS | 5ハャ x 2 |
| 6 | 一次抗体(ウサギ抗チロシン水酸化酵素抗体) | 60分 |
| 7 | PBS | 5ハャ x 2 |
| 8 | ビオチン化二次抗体(ヤギ抗ウサギIgG抗体) | 30分 |
| 9 | PBS | 5ハャ x 2 |
| 10 | HRP標識ストレプトアビジン | 30分 |
| 11 | PBS | 5ハャ x 2 |
| 12 | DAB溶液 | 3-5分 |
| 13 | PBS | 5ハャ x 2 |
| 14 | 染色した切片をゼラチン処理したスライドグラスの上にのせ、乾燥する | |
| 15 | 水洗 | 30秒 |
| 16 | 70%アルコール | 30秒 |
| 17 | 100%アルコール | 2分 |
| 18 | 100%アルコール | 2分 |
| 19 | 100%アルコール | 2分 |
| 20 | キシレン | 2分 |
| 21 | キシレン | 2分 |
| 22 | 封入(エンテランキシレン) | |
DAB溶液
0.05M Tris-HCl Buffer (pH 7.6) 18ml
DAB 5mg
6% Nickel Ammonium Sulfate 2ml
30% H2O2 5μl
−パラフィン切片作製および染色法について−
光学顕微鏡は、試料を透過した光をレンズで拡大して観察しています。そのため、試料は光が透過するだけの薄さに切らなければなりません。薄く切るためには、生のやわらかい試料ではうまくいきません。このため、試料はある程度の強度をもたさなければならず、固定した後、パラフィンに包埋したり凍結したりして試料を硬化させます。この際、試料をできるだけ生きたままの状態で、採取した試薬の処理による変化を防ぐために、試料作製は種々な行程を経なければなりません。
試料作製の行程は次の通りです。
固 定
固定は、採取した試料の死後の変化や、後の試薬による処理過程での変化を防ぐために行います。
生体組織の主な成分は水(80%)、蛋白質(12%)、脂質(7%)です。水の固定は不可能で、脂質(中性脂質:トリグリセライドが主)については後の脱水過程で有機溶媒中に溶けてしまいます。そのため、固定される主要部位は蛋白質になります。
固定剤にはホルマリン、アルコール、ブアン液等が用いられます。
脱水・包埋
試料にパラフィンを浸透させるときに、組織中の水分がそれを妨げます。このため脱水を行います。
脱水剤には主にアルコールを用いますが、アルコールはパラフィンと馴染みませんので、脱水後はパラフィンとの中間剤であるキシレンに置き換えます。その後、パラフィンを浸透させます。
この行程は自動包埋装置という装置で行うことができます。
脱水は次にあるような系列で行います。
| 1 | 70%メタノール | 3時間 |
| 2 | 70%メタノール | 4時間 |
| 3 | 90%メタノール | 3時間 |
| 4 | 90%メタノール | 4時間 |
| 5 | 100%メタノール | 4時間 |
| 6 | 100%キシレン | 1時間 |
| 7 | 100%キシレン | 1時間 |
| 8 | 100%キシレン | 1時間 |
| 9 | パラフィン | 1時間 |
| 10 | パラフィン | 1時間 |
| 11 | パラフィン | 1時間 |
※この行程の時間は、試料が人由来であるか動物か、脳か肝臓等組織の種類にょって多少異なります。また、センターには自動包埋装置が設置されており装置がこの行程を行ってくれます。
パラフィンが浸透した試料は、パラフィンブロック作製装置で包埋し支持台をつけます。その後ミクロトームで薄切します。
薄 切
薄切にはミクロトームを用います。ミクロトームは構造の違いにより、滑走式と回転式に分けることができます。
滑走式は刃をレールの上を滑走させ、固定された試料を切りたい厚みだけ持ち上げ薄切する仕組みになっています。ブロックを持ち上げる仕組みは、ブロック固定装置が傾斜のついたレールの上にあり、切りたい厚みの分だけ傾斜を上るようにしています。このような仕組みのミクロトームが主流でユング型といいます。
回転式は刃を固定し、ブロックを上下させると共に切りたい厚みだけ前進させ薄切するようになっています。ミノー型、スペンサー型と呼ばれるようなものがあります。回転式ミクロトームは、パラフィン切片だけでなく、樹脂に包埋した試料を薄切することも可能です。
今回、薄切に用いますのは図の滑走式ミクロトームのユング型のものです。
HE染色法は最もよく用いられる染色法です。この染色法はほとんど全ての染色の元になる手法です。組織の染め分けには、他にも各種の染色法がありますが、それらはHE染色の補助染色法と考えても差し支えないと思われます。
HE染色では、ヘマトキシリンで細胞核を、エオジンで細胞質その他が染まります。各液の作り方は次の通りです。
マイヤーヘマトキシリン液
| ヘマトキシリン | 1.0g |
| 蒸留水 | 1,000ml |
| ヨウ素酸ナトリウム | 0.2g |
| カリミョウバン | 50g |
| 抱水クロラール | 50g |
| 結晶性クエン酸 | 1.0g |
約1リッターの器に水道水を入れ、そこに数滴のヘマトキシリン液を加える。液の色が変化して、みるみる淡い青紫色調の液に変化すれば使用可能で、淡い赤褐色調になった場合は使用してもよい染色効果を得られない。
保存は褐色ビンで2〜3ヶ月できる。
エオジン・アルコール液
| 1.0%エオジンY液 | 25ml |
| 95%エタノール | 170ml |
| 酢酸 | 1.5ml |
エオジンY液を酢酸に溶かし、エタノールを加える。
染色手順
前処理:脱パラフィン(各種染色を行う前には必ず脱パラフィンを行う)
| 1 | キシレン−I | 10分 |
| 2 | キシレン−II | 10分 |
| 3 | 100%エタノール−I | 1〜2分 |
| 4 | 100%エタノール−II | 1〜2分 |
| 5 | 95%エタノール−III | 1〜2分 |
| 6 | 70%エタノール−I | 1〜2分 |
| 7 | 流水洗 | 1〜2分水を換え5〜6回 |
HE染色(マイヤーヘマトキシリンの場合)
| 1 | 脱パラフィンを行う | |
| 2 | ヘマトキシリン | 5〜10分 |
| (ヘマトキシリン液の種類により時間を調整する) | ||
| 3 | 流水洗(色出し) | 10〜30分 |
| (水洗の最初に核だけが青く染まり背景が無色かごく薄く染まっているかを確認すること) | ||
| 4 | エオジン | 2〜30分 |
| 5 | 水洗 | 水を換え数回 |
| 6 | 70%エタノール−I | 5秒〜5分 |
| (エオジンの染色状態を調整する) | ||
| 7 | 100%エタノール−I | 1〜2分 |
| 8 | 100%エタノール−II | 1〜2分 |
| 9 | 100%エタノール−III | 1〜2分 |
| 10 | キシレン−I | 2分 |
| 11 | キシレン−II | 2分 |
| 12 | 封入(エンテランキシレン) | |
 前へ 前へ
|
先頭へ
|
Last Updated 2005/8/8













