フローサイトメーターFACScanの使用法
生化学第二講座 前田 利長
1. はじめに
1-1. フローサイトメトリー(Flow Cytometory)とは
細胞浮遊液を高速で流して測定し、一個一個の細胞を解析研究する手法のこと
・フローサイトメーター(Flow Cytometer)= FACScan
- フローサイトメトリーで使う細胞解析用の装置
・セルソーター(Cell Sorter)
- フローサイトメトリーで使う細胞解析および細胞分離装置
1-2. フローサイトメーターで何ができるか?
フローセル内を流れる細胞にレーザー光をあて、細胞からの前方散乱光(FSC)、側方散乱光(SSC)、3つの蛍光の5つのパラメータを測定し、細胞の特性を決める。
・FSC ( Forward scatter = 前方散乱光) =細胞の大きさを示す。
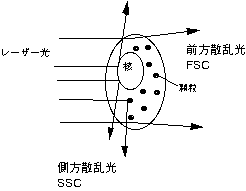 - 細胞の表面積に散乱強度が比例する。
- 細胞の表面積に散乱強度が比例する。- レーザー光軸に対し前方で検出する。
・SSC (Side scatter = 側方散乱光) =顆粒、または、細胞内構造を示す。
- 細胞の顆粒や構造状態に散乱光強度が比例する。
- レーザー光軸に対し90度の角度で検出する。
・FL1、FL2、FL3 (Fluorecence=蛍光強度)= 蛍光強度を示す。
- FACScan はアルゴンレーザー1基のため2色解析を行うことが多い。
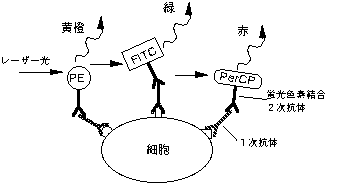
1-4. タンパク質に結合させて使える蛍光色素
FITC:フルオレセインイソシアネート
励起光 488nm → 蛍光は緑(530nm) − FL1で検出
PE:フィコエリスリン
励起光 488nm → 蛍光は黄橙(585nm) − FL2で検出
PerCP:ペリオジニン クロロフィル プロテイン
励起光 488nm → 蛍光は赤(680nm) − FL3で検出
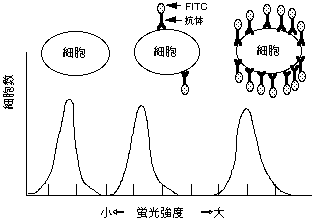
1-5. 蛍光強度
一つの細胞に結合する蛍光標識抗体 は、その細胞の表面抗原の量と比例することから、蛍光強度と表面抗原の量が比例する。
2. 抗体による細胞表面抗原の染色
2-1. 直接免疫蛍光染色
蛍光色素FITC やPE と結合しているモノクローナル抗体を用いて細胞集団を処理し、細胞表面の特異的な抗原を持つ細胞を検出する方法。
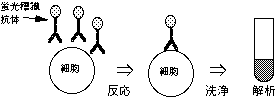
2-2. 間接免疫蛍光染色
蛍光標識抗体がないときや蛍光発色量を増幅する時に使う方法。細胞表面抗原の絶対数を算出するには不向きだが、細胞集団間での相対的な量を出すことができる。
2-2-1. ビオチン-アビジン法
細胞をビオチン結合モノクローナル抗体と反応した後、蛍光色素標識アビジンと反応させる。
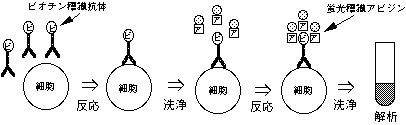
2-2-2. 2重抗体法
細胞を蛍光標識していないモノクローナル抗体(1次抗体と呼ぶ)と反応させた後、蛍光標識した2次抗体(1次抗体と反応するもの)と反応させる。
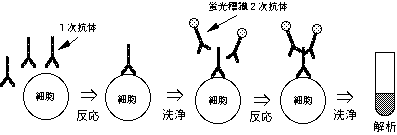
【実例1】
細胞表面に分布するインテグリンを2重抗体法を用いて染色する。
3. 蛍光色素による直接染色
細胞成分を直接色素で染色する場合で、(1) DNAと結合して蛍光を発する色素、(2) RNAと結合して蛍光を発する色素、(3) Ca2+ とキレートして蛍光を発する色素、(4) 細胞内pH 指示色素、(5) 酵素による分解で蛍光色素を遊離する基質などが存在する。しかし、アルゴンレーザー(励起光488 nm)のみを搭載したFACScanでは使用できる色素が限られる。
3-1. DNAと結合する色素
PI:プロピジウム イオジド
励起光 490nm → 発色蛍光 610 nm − FL2で検出
EB:エチジウム ブロマイド
励起光 480nm → 発色蛍光 610 nm − FL2で検出
AO:アクリジンオレンジ
励起光 488nm → 発色蛍光 530 nm − FL1で検出?
細胞を固定し、可溶化剤で細胞膜などを壊し、RNAも分解した後、蛍光色素と反応させ、DNAを検出する。
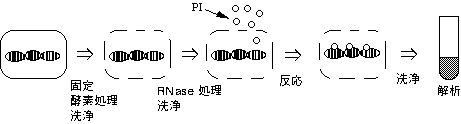
3-2. その他の結合色素
RNA:AO(アクリジンオレンジ)
励起光 488nm → 発色蛍光 620 nm − FL2で検出
Ca2+:fluo 3(フルオ3)
励起光 488nm → 発色蛍光 530 nm − FL1で検出
4. DNA解析
細胞は、細胞周期に従って増殖する。この時、細胞内の核の染色体も増加する。染色体はDNAからできているので、DNA量を測定することで、細胞が細胞周期のどの状態にあるかを推定できる。DNAに特異的に結合する蛍光色素で細胞を処理すると、その蛍光量よりDNA量が推定できる。
4-1. 細胞周期
G0期:細胞休止状態、DNA量2x
G1期:細胞増殖開始、DNA量2x
S 期:DNA合成期、DNA量2〜4x
G2期:細胞分裂直前、DNA量4x
M 期:細胞分裂、母細胞が2つの嬢細胞になる、DNA量2x
4-2. 細胞周期と蛍光強度
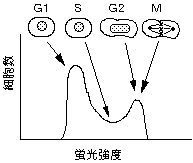
【実例2】
CycleTEST 試薬(ベクトン・ディッキンソン社)を用いたDNA解析
 前へ 前へ
|
先頭へ
|
Last Updated 2005/8/17













